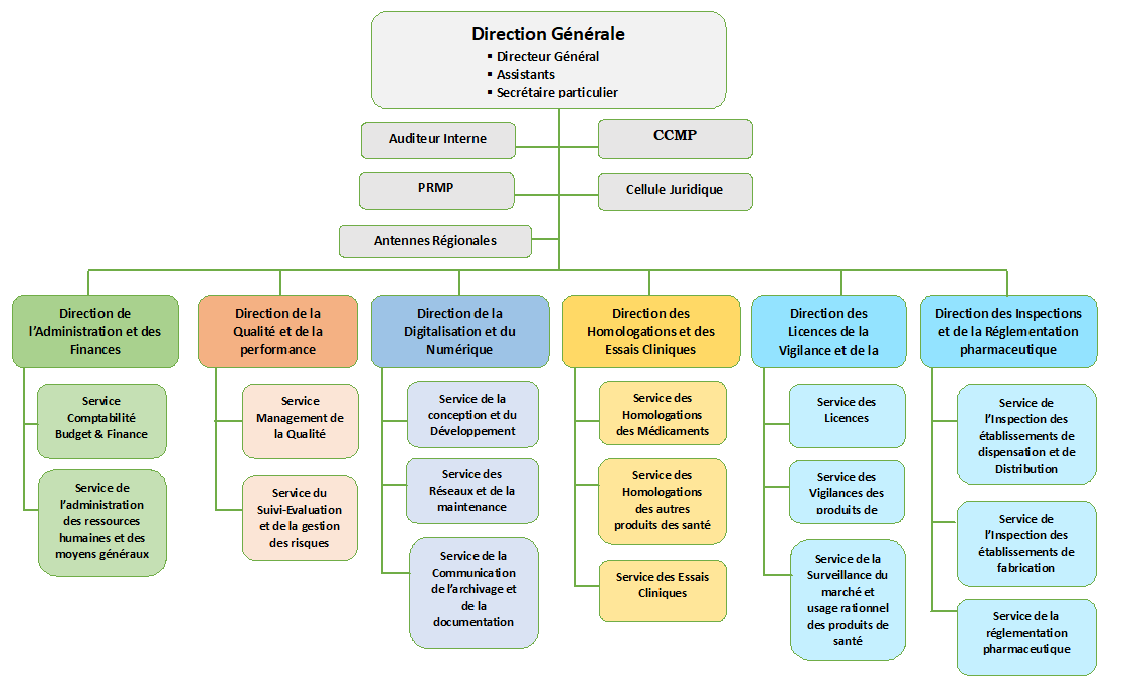
Attribution, Organisation et Fonctionnement
Direction Générale et Directions Techniques
La Direction de l'Administration et des Finances est dirigée par un Administrateur des Services Financiers ou toute autre personne titulaire d'un diplôme équivalent ayant au moins six (6) années d'expériences professionnelles.
Le Directeur de l'Administration et des Finances est nommé par décision du Directeur Général après appel à candidatures de la Direction générale de l'Agence ou par tirage du fichier national d'admission et de nomination des cadres aux emplois de la chaîne des dépenses publiques.
La Direction de l'Administration et des Finances assure la gestion de l'administration, des ressources humaines, financières, matérielles et des services généraux au sein de l'Agence.
A ce titre, elle est chargée :
• de coordonner la gestion efficiente de l'administration, des ressources financières, humaines et matérielles de l'Agence ;
• d'assurer la préparation et l'élaboration du budget de l'Agence ;
• d'assurer la gestion administrative de l'Agence
• d'assurer la mobilisation des ressources financières de l'Agence ;
• de suivre l'exécution financière des activités de l'Agence ,
• d'assurer la justification de l'utilisation des ressources financières quelle que soit leur origine ;
• d'élaborer les documents de reddition de compte de chaque exercice ;
• de mettre en œuvre et d'actualiser les outils et plans de développement des ressources humaines ;
• d'appliquer les textes réglementaires, normes et procédures en matière de gestion des ressources humaines de l'Agence ,
• de veiller aux bonnes conditions de travail et à la qualité de l'environnement de travail
• de coordonner l'élaboration, la mise en œuvre et le suivi des plans de formation et autres documents stratégiques de développement des ressources humaines de l'Agence
• d'organiser et de contrôler la gestion des stocks et la maintenance des infrastructures, des matériels et des équipements.
La Direction de l'Administration et des Finances comprend :
• le Service de la Comptabilité, du Budget el des Finances (SCBF) ;
• le Service de l'Administration, des Ressources Humaines et des Moyens Généraux (SARHMG).
La Direction de l'Administration et des Finances est composée des agents dont les profils sont les suivants :
• Attaché des services administratifs (logisticien, secrétaire de direction, gestionnaire des ressources humaines)
• Attaché des services financiers
• Contrôleur des services financiers
La Direction de la Qualité et de la Performance est dirigée par une personne titulaire d'un master en assurance qualité ou toute autre personne justifiant d'un diplôme équivalent ou jugé pertinent avec une expérience technique d'au moins six (06) ans dans le domaine de la qualité. II est nommé par décision du Directeur Général après approbation du Conseil d'Administration.
La Direction de la Qualité et de la Performance comprend :
• le Service de Management de la Qualité (SMQ),
• le Service de Suivi Evaluation et de la Gestion des Risques (SSEGR).
La direction de la Direction de la Qualité et de la Performance est composée des agents dont les profils sont les suivants :
• Ingénieur en planification
• Pharmacien
• Chimiste
• Biologiste
• Qualiticien
• Agent administratif
La direction de la Qualité et de la Performance est chargée :
• d'élaborer et de mettre en œuvre la politique qualité de l'Agence,
• de superviser et de coordonner les activités liées au système de management de la qualité (rédaction, actualisation des procédures, audits qualité, intégrité du système documentaire),
• de participer à l'élaboration, au suivi et à l'actualisation du plan de développement institutionnel,
• de coordonner la mise en œuvre des actions définies dans le plan de développement institutionnel;
• de définir des indicateurs de performance et assurer leur suivi,
• de veiller à l'amélioration continue du système de management de la qualité,
• de garantir la conformité aux exigences légales, normatives, réglementaires et aux autres standards internationaux portant sur la réglementation pharmaceutique,
• de contribuer sous la direction du Directeur Général à examiner les performances du système de management de la qualité,
• d'assurer la formation et la sensibilisation du personnel à la qualité ,
• de coordonner les travaux de planification et de suivi-évaluation des activités,
• de coordonner l'élaboration de la cartographie des risques et son plan de mitigation,
• de veiller à la mise en œuvre du plan de mitigation des risques,
• de superviser la production des données statistiques des activités de l'Agence.
La Direction des Homologations et des Essais Cliniques est dirigée par un pharmacien ayant au moins six (6) années d'expériences dans le domaine de l'homologation des produits de santé ou des essais cliniques. Il est nommé par décision du Directeur Général après approbation du Conseil d'Administration.
La Direction des Homologations et des Essais cliniques est chargée :
• de coordonner l'enregistrement des produits de santé, le renouvellement, les variations, les abrogations, les retraits autorisations de mise sur le marché ou des autorisations de commercialisation des produits de santé ,
• de coordonner les activités et les sessions de la commission nationale d'homologation des produits de santé ;
• de coordonner les activités et les sessions du comité technique d'homologation des produits de santé ;
• de coordonner les activités et les sessions de la commission tarifaire en collaboration avec les parties prenantes ;
• de signer les notifications des avis de la commission nationale d'homologation des produits de santé ;
• de valider les projets d'Autorisation de mise sur le marché et d'autorisations de commercialisation des produits de santé ,
• de coordonner les activités pour l'autorisation et la supervision des essais cliniques
• de contribuer à l'élaboration des normes et dispositions juridiques en matière d'homologation des produits de santé ;
• d'élaborer et de faire appliquer les normes et standards relatifs aux essais cliniques ;
• d'évaluer la performance de la Direction et de proposer des axes d'amélioration.
La Direction des Homologations et des Essais cliniques comprend :
• Le Service des Homologations des Médicaments (SHM) ;
• Le Service des Homologations des autres Produits de Santé (SHAPS) ;
• Le Service des Essais Cliniques (SEC).
La direction est composée des agents dont les profils sont les suivants :
• Pharmaciens ;
• Chimistes
• Spécialistes des plantes médicinales ;
• Agents administratifs.
La Direction des Inspections et de la Réglementation Pharmaceutique est dirigée par un pharmacien inspecteur ayant au moins six (06) années d'expériences en inspections pharmaceutiques. Il est nommé par décision du Directeur Général après approbation du Conseil d'Administration.
La Direction des Inspections et de la Réglementation Pharmaceutique est chargée :
• d'organiser et de coordonner les activités d'inspections y compris les inspections de vigilance, selon un programme annuel ou inopiné de toutes les structures concernées y compris les opérateurs (établissements pharmaceutiques, fabricants, exploitants, importateurs, distributeurs, détaillants, promoteurs d'essais cliniques, investigateurs, installations d'essais, établissements de sang et de tissus, toutes autres installations de détention des produits de santé y compris les médicaments vétérinaires,...)
• de traiter toutes les demandes d'inspection relatives à la qualité, à l'efficacité et à la sécurité des produits de santé y compris les substances actives et les essais cliniques
• d'organiser et d’assurer le suivi des inspections des laboratoires de contrôle de qualité des établissements pharmaceutiques de fabrication agréés ;
• de procéder au contrôle de tout produit de santé lors de son entrée sur le territoire
• d'appuyer les autres entités de l'Agence dans le suivi des produits de santé le long de la chaine d'approvisionnement jusqu'à leur destruction ,
• de coordonner l'organisation et la mise en œuvre des opérations de lutte contre les produits de santé de qualité inférieure et/ou falsifiés en collaboration avec les structures compétentes ;
• de contribuer à l'élaboration des projets de textes législatifs et réglementaires ;
• de développer les outils méthodologiques d'inspection,
• d'évaluer la performance des interventions en matière d'inspection et de proposer des axes d'amélioration.
La Direction des Inspections et de la Réglementation Pharmaceutique comprend :
• le Service de l'inspection des Établissements de Dispensation et de Distribution (SIEDD),
• le Service de l'inspection des Établissements de Fabrication (SIEF),
• le Service de la Réglementation Pharmaceutique (SRP).
La direction est composée des agents dont les profils sont les suivants :
• Pharmacien,
• Vétérinaire,
• Chimiste,
• Biologiste, biomédical, biotechnologiste, bioingénieur,
• Agents administratifs.
La Direction des Licences, de la Vigilance et de la Surveillance du Marché est dirigée par un pharmacien ayant au moins six (6) années d'expériences en matière de vigilances ou de surveillance du marché ou de réglementation pharmaceutique. Il est nommé par décision du Directeur Général après approbation du Conseil d'Administration.
La Direction des Licences, de la Vigilance et de la Surveillance du Marché est chargée :
• d'assurer la mise en place, l'actualisation et la conformité du cadre juridique pour la vigilance, l'octroi de licences aux établissements ainsi que la surveillance et le contrôle du marché,
• de coordonner la mise en œuvre des activités de vigilance, de l'octroi de licences aux établissements et de la surveillance et le contrôle du marché,
• de veiller à la conformité des activités de la vigilance, de l'octroi de licences aux établissements et de la surveillance et le contrôle du marché aux lois nationales et aux standards internationaux,
• d'instaurer une gouvernance efficace, transparente et éthique pour la vigilance, l'octroi de licences aux établissements et la surveillance et le contrôle du marché,
• de veiller à la mise en œuvre du plan de formation des acteurs des trois fonctions réglementaires,
• de définir et suivre des indicateurs de performance pour ses collaborateurs,
• de contribuer à l'amélioration continue pour toutes les activités de la vigilance, de l'octroi de licences aux établissements et de la surveillance et le contrôle du marché,
• de coordonner la diffusion régulière des résultats et alertes de vigilance auprès des parties prenantes,
• de contribuer à la promotion der de la transparence dans toutes les décisions réglementaires,
• de communiquer efficacement avec les établissements de santé, le public et les partenaires,
• de publier en collaboration avec la Direction de la Digitalisation et du Numérique les données non confidentielles sur l'octroi de licences aux établissements pharmaceutiques, les rappels de produits de santé et les sanctions,
• de communiquer avec les autorités sanitaires nationales, régionales et internationales (ex. OMS).
La Direction des Licences, de la Vigilance et de la Surveillance du Marché comprend :
• Le Service des Licences (SL),
• Le Service des Vigilances des Produits de Santé (SVPS),
• Le Service de la Surveillance du Marché et de l'Usage Rationnel des Produits de Santé (SMUR).
La direction est composée des agents dont les profils sont les suivants
• Pharmacien,
• Épidémiologiste,
• Agent administratif.
La Direction de la Digitalisation et du numérique est dirigée par une personne titulaire au moins d'un diplôme d'ingénieur en systèmes d'information, d'un master en gestion des systèmes d'information, ou d'un diplôme équivalent en ingénierie ou management des système d'information avec une expérience technique d'au moins six (06) ans dans le domaine du management des systèmes d'information. Il est nommé par décision du Directeur Général après approbation du Conseil d'Administration.
La Direction de la Digitalisation et du Numérique (DDN) comprend :
• le service de la Conception et du Développement ;
• le service des Réseaux et de la Maintenance,
• le service de la communication, de l'archivage et de la documentation.
La direction de la digitalisation et du numérique (DDN), est composée des agents dont les profils sont les suivants :
• Ingénieur des Systèmes d'information
• Ingénieur en réseaux informatiques et télécommunications
• Analyste programmeur
• Attaché de communication
• Archiviste
• Spécialiste en sécurité informatique
• Spécialiste en gestion de projets informatiques
La Direction de la Digitalisation et du Numérique est chargée :
• d'élaborer et de diriger la mise en œuvre de la stratégie digitale alignée sur les objectifs de l'Agence ;
• de collaborer avec les autres directions pour la digitalisation complète des lignes de métiers de l'Agence ;
• d'élaborer et de mettre en œuvre les stratégies de sécurité, de protection des données et de communication de l'Agence ;
• de participer à la mise en œuvre des activités de sensibilisation sur les produits de santé ;
• de diriger les portefeuilles de projets structurants de digitalisation de l'Agence ;
• de coordonner l'amélioration continue des processus de digitalisation de l'Agence sur la base des indicateurs de performances ,
• de coordonner avec les directions en charge, la définition des budgets de digitalisation et de Ieur utilisation optimale ;
• de coordonner la formation et le support des clients de l'Agence à l'utilisation optimale des systèmes digitalisés ;
• de coordonner une veille technologique constante, en identifiant les nouvelles opportunités pour les objectifs de l'Agence ;
• de coordonner les projets et opérations de sous-traitance informatiques ;
• de coordonner les interventions internes et externes dans le cadre des activités de digitalisation de l'Agence.
Cellules rattachées au Directeur Général
La Personne Responsable des Marchés Publics est un cadre titulaire d'un master en marchés publics et justifiant d'une expérience professionnelle d'au moins six (6) ans en passation des marchés. Elle est nommée par décision du Directeur Général après recrutement par appel à candidatures de la Direction générale de l'Agence ou tirage au fichier national d'admission et de nomination des cadres aux emplois de la chaine des dépenses publiques. La Personne Responsable des Marchés Publics a rang de Directeur technique.
La Personne Responsable des Marchés Publics est chargée :
• de piloter toutes les procédures de passation des marchés,
• d'élaborer et de mettre périodiquement à jour, les procédures de passation des marchés conformément aux dispositions en vigueur,
• d'élaborer annuellement et de mettre à jour le plan de passation des marchés publics,
• d'organiser les appels à concurrence, le dépouillement et l'analyse des offres,
• d'élaborer et de faire approuver les contrats de marchés publics avant leur signature,
• de conclure les marchés, de suivre leur exécution et de réceptionner les livrables,
• de rendre compte, à l'autorité contractante, de l'exécution des marchés.
Pour la mise en œuvre de ses attributions, la Personne Responsable des Marchés Publics met en place un Secrétariat dénommé « Secrétariat de la Personne Responsable des Marchés Publics ». Le Secrétariat de la Personne Responsable des Marchés Publics est composé d'un (e) assistant (e) spécialiste en marchés publics et d'un (e) secrétaire.
La Cellule de Contrôle des Marchés Publics est dirigée par un cadre titulaire d'un master en marchés publics et justifiant d'une expérience professionnelle d'au moins six (6) ans. Le chef de la cellule de contrôle des marchés publics est recruté par appel à candidatures de la Direction générale de l'Agence ou tiré au fichier national des cadres spécialistes en marchés publics. Il est nommé par décision du Directeur Général après approbation du Conseil d'Administration. Il a rang de Directeur technique.
Le chef de la cellule de contrôle des marchés publics dispose d'un secrétaire et est appuyé par un (01) juriste et un spécialiste du domaine pharmaceutique.
La Cellule de Contrôle des Marchés Publics est chargée :
• de procéder à la validation du plan de passation des marchés de l'agence avant sa publication par la direction nationale de contrôle des marchés publics;
• de procéder à la validation des dossiers d'appel à concurrence avant le lancement de la procédure ainsi que leur modification, le cas échéant
• d'assister aux opérations d'ouverture des plis et signer le procès-verbal d'ouverture;
• de procéder à la validation du rapport d'analyse comparative des propositions et du procès-verbal d'attribution provisoire du marché approuvé par la commission d'ouverture et d'évaluation des offres
• de procéder à un examen juridique et technique du projet de marché avant son approbation;
• de procéder au contrôle à priori des demandes de renseignements et de prix;
• de produire les rapports trimestriels et annuels de ses activités.
L'auditeur interne est titulaire d'un master en Audit interne et contrôle de gestion et justifie d'une expérience professionnelle d'au moins six (6) ans. Il est nommé par le Directeur Général après approbation du Conseil d'Administration. Il a rang de directeur technique.
L'auditeur interne est chargé :
• d'élaborer, de définir et de piloter le dispositif d'audit, de contrôle interne, de l'Agence;
• de conduire les missions d'audit interne;
• d'évaluer le dispositif de contrôle existant,
• d'évaluer l'efficacité du plan de mitigation des risques en lien avec les autres structures de l'Agence impliquées dans la gestion des risques,
• de contrôler de la mise en œuvre des recommandations issues des audits internes et externes, et des différentes missions de supervision ;
• de produire les rapports périodiques relatifs à l'orientation et au contrôle de l'Agence,
• d'assurer la liaison entre l'Agence et le commissaire aux comptes ainsi que les comités ministériels de maîtrise des risques et d'audit interne.
Une antenne régionale est une structure déconcentrée de l'Agence béninoise du Médicament et des autres produits de Santé. Elle assure la mise en œuvre, dans son ressort territorial, de certaines fonctions réglementaires relevant des Directions techniques de l'Agence.
Elle est animée par un personnel dont les profils sont définis par décision du Directeur Général. Elle est dirigée par un Chef d'Antenne, un pharmacien ayant au moins six (06) années d'expériences et nommé par décision du Directeur Général. II a rang de Directeur technique.
Elle fonctionne conformément aux dispositions législatives, réglementaires et techniques qui régissent l'Agence.
Les Antennes sont chargées :
• d'encadrer, superviser et coordonner les activités relevant de leurs prérogatives;
• d'assurer la mise en œuvre des fonctions réglementaires pharmaceutiques au niveau régional en collaboration avec les responsables desdites fonctions,
• de produire des rapports périodiques sur les activités de l'Antenne Régionale,
• de faire respecter les exigences normatives et réglementaires ainsi que les procédures et les lignes directrices adoptées par l'Agence.
La Cellule Juridique est dirigée par un cadre titulaire d'un master en droit ayant au moins six (6) années d'expériences professionnelles dont deux au minimum dans le domaine pharmaceutique. Il est nommé par décision du Directeur Général après approbation du Conseil d'Administration. Il a rang de Directeur technique.
Il est assisté de deux juristes, titulaires d'un master en droit ou d'un diplôme équivalent et ayant au moins deux (2) années d'expériences professionnelles.
La cellule juridique est chargée :
• de conseiller le Directeur Général sur le plan juridique,
• de superviser la rédaction des projets de textes législatifs et réglementaires du sous-secteur pharmaceutique,
• de veiller à l'application des conventions internationales ratifiées par le Bénin,
• de rédiger et vérifier les textes juridiques de l'Agence,
• de vérifier la régularité juridique des contrats liant l'Agence,
• d'assurer la régularité et la veille législative et réglementaire des activités de l'Agence,
• d'apporter un appui juridique aux différentes entités de l'Agence,
• de participer aux réflexions concernant le règlement des litiges impliquant l'Agence,
• d'élaborer les projets d'actes de procédure dans le cadre des contentieux impliquant l'Agence,
• de participer aux audiences liées à la gestion des contentieux impliquant l'Agence.
Organe de Renforcement de la Gouvernance
Le comité de Directions est présidé par le Directeur Général et comprend les Directeurs techniques et assimilés. L'un des Assistants du Directeur Général assiste aux séances du Comité de Directions et en est le rapporteur.
Le Comité de Directions est chargé:
• de faire le point d'exécution des activités de l'Agence ;
• d'arrêter les modalités de mise en œuvre des instructions du Conseil d'Administration ;
• de donner des orientations dans le cadre de la préparation du budget de l'Agence ;
• d'examiner les revues du cadre de performance de l'Agence par rapport à la mission et aux objectifs de l'Agence sur la base des progrès enregistres, des difficultés rencontrées, des leçons et des perspectives ;
• de donner son avis sur les cas de manquement aux règles disciplinaires de la réglementation relative à l'exercice de la profession pharmaceutique.
Le Comité de Direction se réunit toutes les deux (02) semaines et toutes les fois en cas de besoin.
Le Comité de Directions élargi est présidé par le Directeur Général et comprend les Directeurs techniques et assimilés et les chefs de service. L'un des Assistants du Directeur Général assiste aux séances du Comité de Directions élargi et en est le rapporteur.
Le Comité de Directions élargi est chargé:
• de faire le point d'exécution des activités de l'Agence ;
• de mettre en œuvre es instructions du Comité de Directions ;
• de participer à la préparation du budget de l'Agence ;
• de participer à la revue du cadre de performance de l'Agence par rapport à la mission et aux objectifs de l'Agence sur la base des progrès enregistrés, des difficultés rencontrées, des leçons et des perspectives ;
Le Comité de Direction élargi se réunit tous les trois (03) mois et toutes les fois en cas de besoin.
Le comité Qualité a pour mission de renforcer le service de management de la qualité pour garantir la mise en œuvre, le maintien et l'amélioration continue du système de management de la qualité conformément aux exigences de la norme ISO 9001.
A ce titre, il est chargé :
• de maintenir l'intégrité du Système de Management de la Qualité (SMQ) lors de la planification et de la réalisation de changements ;
• de planifier le développement du SMQ
• de sensibiliser le personnel de l'ABMed sur leurs responsabilités en matière de qualité et l'importance de répondre aux exigences des clients ;
• d'évaluer périodiquement l'efficacité du SMQ ;
• de coordonner la gestion des plaintes, réclamation et recours découlant des services fournis par l'ABMed, des éléments de management et des règlements ;
• de coordonner en collaboration avec le service de suivi évaluation et gestion des risques le pilotage de l'actualisation de la cartographie des risques et de la mise en œuvre du plan de mitigation des risques ;
• d'approuver le rapport périodique sur le fonctionnement du SMQ à soumettre au Directeur Général ;
• de lire et valider le contenu des textes ou documents avant toute publication sur tous les réseaux sociaux et site de l'Agence.
• Le Comité se réunit toutes les fois en cas de besoin et dispose d'un règlement qui régit son fonctionnement.
La composition du CQ est précisée dans la note de service de nomination de ses membres.
Le coordinateur du CQ est le chef du service de management de la qualité. Il dirige les sessions et approuve le programme des réunions du CQ.
Son rapporteur est un personnel du service de management de la qualité. Il prépare les sessions du CQ.
